

Frontiers of Chemical Science and Engineering >
Cationic and amphipathic cell-penetrating peptides (CPPs): Their structures and in vivo studies in drug delivery
Received date: 10 Jul 2015
Accepted date: 11 Aug 2015
Published date: 26 Nov 2015
Copyright
Over the past few decades, cell penetrating peptides (CPPs) have become an important class of drug carriers for small molecules, proteins, genes and nanoparticle systems. CPPs represent a very diverse set of short peptide sequences (10‒30 amino acids), generally classified as cationic or amphipathic, with various mechanisms in cellular internalization. In this review, a more comprehensive assessment of the chemical structural characteristics, including net cationic charge, hydrophobicity and helicity was assembled for a large set of commonly used CPPs, and compared to results from numerous in vivo drug delivery studies. This detailed information can aid in the design and selection of effective CPPs for use as transport carriers in the delivery of different types of drug for therapeutic applications.
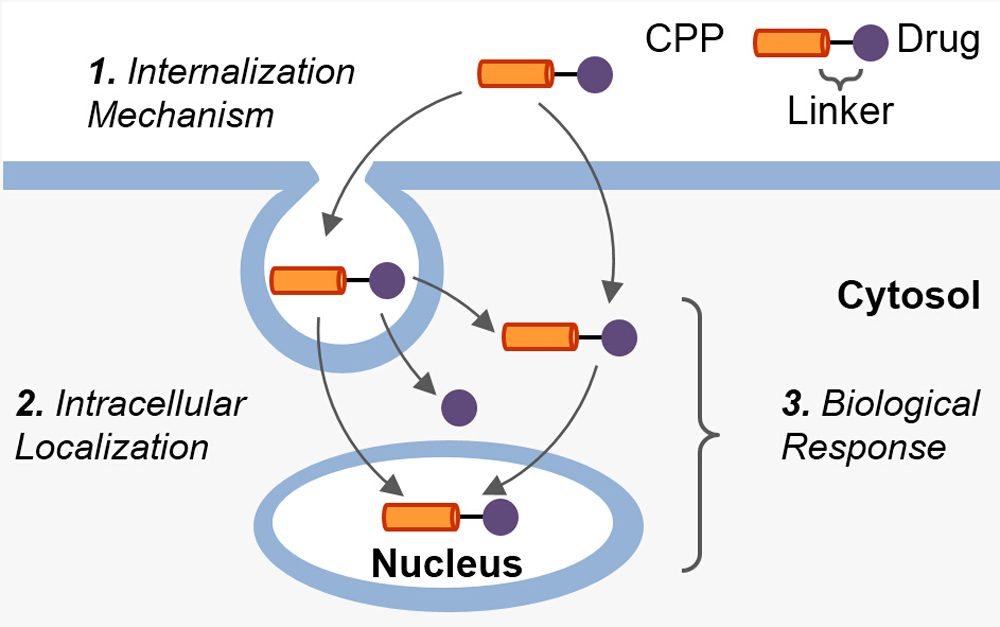
Key words: cell penetrating peptides; amphipathic peptides; drug delivery
Jennica L. Zaro , Wei-Chiang Shen . Cationic and amphipathic cell-penetrating peptides (CPPs): Their structures and in vivo studies in drug delivery[J]. Frontiers of Chemical Science and Engineering, 2015 , 9(4) : 407 -427 . DOI: 10.1007/s11705-015-1538-y
| 1 |
Green M, Loewenstein P M. Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein. Cell, 1988, 55(6): 1179–1188
|
| 2 |
Frankel A D, Pabo C O. Cellular uptake of the tat protein from human immunodeficiency virus. Cell, 1988, 55(6): 1189–1193
|
| 3 |
Patel L N, Zaro J L, Shen W C. Cell penetrating peptides: Intracellular pathways and pharmaceutical perspectives. Pharmaceutical Research, 2007, 24(11): 1977–1992
|
| 4 |
Vasconcelos L, Madani F, Arukuusk P, Parnaste L, Graslund A, Langel U. Effects of cargo molecules on membrane perturbation caused by transportan10 based cell-penetrating peptides. Biochimica et Biophysica Acta, 2014, 1838(12): 3118–3129
|
| 5 |
Grdisa M. The delivery of biologically active (therapeutic) peptides and proteins into cells. Current Medicinal Chemistry, 2011, 18(9): 1373–1379
|
| 6 |
Dietz G P, Bahr M. Delivery of bioactive molecules into the cell: The Trojan horse approach. Molecular and Cellular Neurosciences, 2004, 27(2): 85–131
|
| 7 |
Copolovici D M, Langel K, Eriste E, Langel U. Cell-penetrating peptides: Design, synthesis, and applications. ACS Nano, 2014, 8(3): 1972–1994
|
| 8 |
Bechinger B, Aisenbrey C. The polymorphic nature of membrane-active peptides from biophysical and structural investigations. Current Protein & Peptide Science, 2012, 13(7): 602–610
|
| 9 |
El-Andaloussi S, Holm T, Langel U. Cell-penetrating peptides: Mechanisms and applications. Current Pharmaceutical Design, 2005, 11(28): 3597–3611
|
| 10 |
Walrant A, Bechara C, Alves I D, Sagan S. Molecular partners for interaction and cell internalization of cell-penetrating peptides: How identical are they? Nanomedicine (London), 2012, 7(1): 133–143
|
| 11 |
Lewis H D, Husain A, Donnelly R J, Barlos D, Riaz S, Ginjupalli K, Shodeinde A, Barton B E. Creation of a novel peptide with enhanced nuclear localization in prostate and pancreatic cancer cell lines. BMC Biotechnology, 2010, 10(1): 79
|
| 12 |
Ragin A D, Morgan R A, Chmielewski J. Cellular import mediated by nuclear localization signal peptide sequences. Chemistry & Biology, 2002, 9(8): 943–948
|
| 13 |
Sadler K, Eom K D, Yang J L, Dimitrova Y, Tam J P. Translocating proline-rich peptides from the antimicrobial peptide bactenecin 7. Biochemistry, 2002, 41(48): 14150–14157
|
| 14 |
Jha D, Mishra R, Gottschalk S, Wiesmuller K H, Ugurbil K, Maier M E, Engelmann J. CyLoP-1: A novel cysteine-rich cell-penetrating peptide for cytosolic delivery of cargoes. Bioconjugate Chemistry, 2011, 22(3): 319–328
|
| 15 |
De Coupade C, Fittipaldi A, Chagnas V, Michel M, Carlier S, Tasciotti E, Darmon A, Ravel D, Kearsey J, Giacca M, Cailler F. Novel human-derived cell-penetrating peptides for specific subcellular delivery of therapeutic biomolecules. Biochemical Journal, 2005, 390(2): 407–418
|
| 16 |
Futaki S, Suzuki T, Ohashi W, Yagami T, Tanaka S, Ueda K, Sugiura Y. Arginine-rich peptides. An abundant source of membrane-permeable peptides having potential as carriers for intracellular protein delivery. Journal of Biological Chemistry, 2001, 276(8): 5836–5858
|
| 17 |
Nakase I, Hirose H, Tanaka G, Tadokoro A, Kobayashi S, Takeuchi T, Futaki S. Cell-surface accumulation of flock house virus-derived peptide leads to efficient internalization via macropinocytosis. Molecular Therapy, 2009, 17(11): 1868–1876
|
| 18 |
Langedijk J P, Olijhoek T, Schut D, Autar R, Meloen R H. New transport peptides broaden the horizon of applications for peptidic pharmaceuticals. Molecular Diversity, 2004, 8(2): 101–111
|
| 19 |
Bong D T, Steinem C, Janshoff A, Johnson J E, Reza Ghadiri M. A highly membrane-active peptide in Flock House virus: Implications for the mechanism of nodavirus infection. Chemistry & Biology, 1999, 6(7): 473–481
|
| 20 |
Bertrand J R, Malvy C, Auguste T, Toth G K, Kiss-Ivankovits O, Illyes E, Hollosi M, Bottka S, Laczko I. Synthesis and studies on cell-penetrating peptides. Bioconjugate Chemistry, 2009, 20(7): 1307–1314
|
| 21 |
Trehin R, Krauss U, Beck-Sickinger A G, Merkle H P, Nielsen H M. Cellular uptake but low permeation of human calcitonin-derived cell penetrating peptides and Tat(47-57) through well-differentiated epithelial models. Pharmaceutical Research, 2004, 21(7): 1248–1256
|
| 22 |
Cascales L, Henriques S T, Kerr M C, Huang Y H, Sweet M J, Daly N L, Craik D J. Identification and characterization of a new family of cell-penetrating peptides: Cyclic cell-penetrating peptides. Journal of Biological Chemistry, 2011, 286(42): 36932–36943
|
| 23 |
Thoren P E, Persson D, Isakson P, Goksor M, Onfelt A, Norden B. Uptake of analogs of penetratin, Tat(48-60) and oligoarginine in live cells. Biochemical and Biophysical Research Communications, 2003, 307(1): 100–107
|
| 24 |
Fischer P M, Zhelev N Z, Wang S, Melville J E, Fahraeus R, Lane D P. Structure-activity relationship of truncated and substituted analogues of the intracellular delivery vector Penetratin. Journal of Peptide Research, 2000, 55(2): 163–172
|
| 25 |
Derossi D, Calvet S, Trembleau A, Brunissen A, Chassaing G, Prochiantz A. Cell internalization of the third helix of the Antennapedia homeodomain is receptor-independent. Journal of Biological Chemistry, 1996, 271(30): 18188–18193
|
| 26 |
El-Andaloussi S, Johansson H J, Holm T, Langel U. A novel cell-penetrating peptide, M918, for efficient delivery of proteins and peptide nucleic acids. Molecular Therapy, 2007, 15(10): 1820–1826
|
| 27 |
Duchardt F, Ruttekolk I R, Verdurmen W P, Lortat-Jacob H, Burck J, Hufnagel H, Fischer R, van den Heuvel M, Lowik D W, Vuister G W, Ulrich A, de Waard M, Brock R. A cell-penetrating peptide derived from human lactoferrin with conformation-dependent uptake efficiency. Journal of Biological Chemistry, 2009, 284(52): 36099–36108
|
| 28 |
Scheller A, Oehlke J, Wiesner B, Dathe M, Krause E, Beyermann M, Melzig M, Bienert M. Structural requirements for cellular uptake of alpha-helical amphipathic peptides. Journal of Peptide Science, 1999, 5(4): 185–194
|
| 29 |
Jones S W, Christison R, Bundell K, Voyce C J, Brockbank S M, Newham P, Lindsay M A. Characterisation of cell-penetrating peptide-mediated peptide delivery. British Journal of Pharmacology, 2005, 145(8): 1093–1102
|
| 30 |
Verdurmen W P, Bovee-Geurts P H, Wadhwani P, Ulrich A S, Hallbrink M, van Kuppevelt T H, Brock R. Preferential uptake of L-versus D-amino acid cell-penetrating peptides in a cell type-dependent manner. Chemistry & Biology, 2011, 18(8): 1000–1010
|
| 31 |
Drin G, Cottin S, Blanc E, Rees A R, Temsamani J. Studies on the internalization mechanism of cationic cell-penetrating peptides. Journal of Biological Chemistry, 2003, 278(33): 31192–31201
|
| 32 |
Kilk K, Magzoub M, Pooga M, Eriksson L E, Langel U, Graslund A. Cellular internalization of a cargo complex with a novel peptide derived from the third helix of the islet-1 homeodomain. Comparison with the penetratin peptide. Bioconjugate Chemistry, 2001, 12(6): 911–916
|
| 33 |
Han K, Jeon M J, Kim K A, Park J, Choi S Y. Efficient intracellular delivery of GFP by homeodomains of Drosophila Fushi-tarazu and Engrailed proteins. Molecules and Cells, 2000, 10(6): 728–732
|
| 34 |
Elmquist A, Hansen M, Langel U. Structure-activity relationship study of the cell-penetrating peptide pVEC. Biochimica et Biophysica Acta, 2006, 1758(6): 721–729
|
| 35 |
Wender P A, Mitchell D J, Pattabiraman K, Pelkey E T, Steinman L, Rothbard J B. The design, synthesis, and evaluation of molecules that enable or enhance cellular uptake: Peptoid molecular transporters. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(24): 13003–13008
|
| 36 |
Kamide K, Nakakubo H, Uno S, Fukamizu A. Isolation of novel cell-penetrating peptides from a random peptide library using in vitro virus and their modifications. International Journal of Molecular Medicine, 2010, 25(1): 41–51
|
| 37 |
Takeshima K, Chikushi A, Lee K K, Yonehara S, Matsuzaki K. Translocation of analogues of the antimicrobial peptides magainin and buforin across human cell membranes. Journal of Biological Chemistry, 2003, 278(2): 1310–1315
|
| 38 |
Richard J P, Melikov K, Vives E, Ramos C, Verbeure B, Gait M J, Chernomordik L V, Lebleu B. Cell-penetrating peptides. A reevaluation of the mechanism of cellular uptake. Journal of Biological Chemistry, 2003, 278(1): 585–590
|
| 39 |
Vives E, Brodin P, Lebleu B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. Journal of Biological Chemistry, 1997, 272(25): 16010–16017
|
| 40 |
Hariton-Gazal E, Feder R, Mor A, Graessmann A, Brack-Werner R, Jans D, Gilon C, Loyter A. Targeting of nonkaryophilic cell-permeable peptides into the nuclei of intact cells by covalently attached nuclear localization signals. Biochemistry, 2002, 41(29): 9208–9214
|
| 41 |
Patel L N, Wang J, Kim K J, Borok Z, Crandall E D, Shen W C. Conjugation with cationic cell-penetrating peptide increases pulmonary absorption of insulin. Molecular Pharmaceutics, 2009, 6(2): 492–503
|
| 42 |
Zaro J L, Shen W C. Quantitative comparison of membrane transduction and endocytosis of oligopeptides. Biochemical and Biophysical Research Communications, 2003, 307(2): 241–247
|
| 43 |
Zaro J L, Shen W C. Evidence that membrane transduction of oligoarginine does not require vesicle formation. Experimental Cell Research, 2005, 307(1): 164–173
|
| 44 |
Park Y J, Chang L C, Liang J F, Moon C, Chung C P, Yang V C. Nontoxic membrane translocation peptide from protamine, low molecular weight protamine (LMWP), for enhanced intracellular protein delivery: in vitro and in vivo study. FASEB Journal, 2005, 19(11): 1555–1557
|
| 45 |
Wu F L, Yeh T H, Chen Y L, Chiu Y C, Cheng J C, Wei M F, Shen L J. Intracellular delivery of recombinant arginine deiminase (rADI) by heparin-binding hemagglutinin adhesion peptide restores sensitivity in rADI-resistant cancer cells. Molecular Pharmaceutics, 2014, 11(8): 2777–2786
|
| 46 |
Yang Z, Jiang Z, Cao Z, Zhang C, Gao D, Luo X, Zhang X, Luo H, Jiang Q, Liu J. Multifunctional non-viral gene vectors with enhanced stability, improved cellular and nuclear uptake capability, and increased transfection efficiency. Nanoscale, 2014, 6(17): 10193–10206
|
| 47 |
Morris M C, Depollier J, Mery J, Heitz F, Divita G. A peptide carrier for the delivery of biologically active proteins into mammalian cells. Nature Biotechnology, 2001, 19(12): 1173–1176
|
| 48 |
Kurzawa L, Pellerano M, Morris M C. PEP and CADY-mediated delivery of fluorescent peptides and proteins into living cells. Biochimica et Biophysica Acta, 2010, 1798(12): 2274–2285
|
| 49 |
Lin Y Z, Yao S Y, Veach R A, Torgerson T R, Hawiger J. Inhibition of nuclear translocation of transcription factor NF-kappa B by a synthetic peptide containing a cell membrane-permeable motif and nuclear localization sequence. Journal of Biological Chemistry, 1995, 270(24): 14255–14258
|
| 50 |
Soomets U, Lindgren M, Gallet X, Hallbrink M, Elmquist A, Balaspiri L, Zorko M, Pooga M, Brasseur R, Langel U. Deletion analogues of transportan. Biochimica et Biophysica Acta, 2000, 1467(1): 165–176
|
| 51 |
Kobayashi S, Nakase I, Kawabata N, Yu H H, Pujals S, Imanishi M, Giralt E, Futaki S. Cytosolic targeting of macromolecules using a pH-dependent fusogenic peptide in combination with cationic liposomes. Bioconjugate Chemistry, 2009, 20(5): 953–959
|
| 52 |
El-Sayed A, Futaki S, Harashima H. Delivery of macromolecules using arginine-rich cell-penetrating peptides: Ways to overcome endosomal entrapment. AAPS Journal, 2009, 11(1): 13–22
|
| 53 |
Wyman T B, Nicol F, Zelphati O, Scaria P V, Plank C, Szoka F C J. Design, synthesis, and characterization of a cationic peptide that binds to nucleic acids and permeabilizes bilayers. Biochemistry, 1997, 36(10): 3008–3017
|
| 54 |
Wada S, Tsuda H, Okada T, Urata H. Cellular uptake of aib-containing amphipathic helix peptide. Bioorganic & Medicinal Chemistry Letters, 2011, 21(19): 5688–5691
|
| 55 |
Zaro J L, Vekich J E, Tran T, Shen W C. Nuclear localization of cell-penetrating peptides is dependent on endocytosis rather than cytosolic delivery in CHO cells. Molecular Pharmaceutics, 2009, 6(2): 337–344
|
| 56 |
Gomez J A, Chen J, Ngo J, Hajkova D, Yeh I J, Gama V, Miyagi M, Matsuyama S. Cell-penetrating penta-peptides (CPP5s): Measurement of cell entry and protein-transduction activity. Pharmaceuticals (Basel, Switzerland), 2010, 3(12): 3594–3613
|
| 57 |
Fretz M M, Penning N A, Al-Taei S, Futaki S, Takeuchi T, Nakase I, Storm G, Jones A T. Temperature, concentration- and cholesterol-dependent translocation of L- and D-octa-arginine across the plasma and nuclear membrane of CD34+ leukaemia cells. Biochemical Journal, 2007, 403(2): 335–342
|
| 58 |
Zaro J L, Rajapaksa T E, Okamoto C T, Shen W C. Membrane transduction of oligoarginine in HeLa cells is not mediated by macropinocytosis. Molecular Pharmaceutics, 2006, 3(2): 181–186
|
| 59 |
Cohen-Avrahami M, Libster D, Aserin A, Garti N. Sodium diclofenac and cell-penetrating peptides embedded in H(II) mesophases: Physical characterization and delivery. Journal of Physical Chemistry B, 2011, 115(34): 10189–10197
|
| 60 |
Sheng J, Oyler G, Zhou B, Janda K, Shoemaker C B. Identification and characterization of a novel cell-penetrating peptide. Biochemical and Biophysical Research Communications, 2009, 382(2): 236–240
|
| 61 |
Shen W C, Ryser H J. Conjugation of poly-L-lysine to albumin and horseradish peroxidase: A novel method of enhancing the cellular uptake of proteins. Proceedings of the National Academy of Sciences of the United States of America, 1978, 75(4): 1872–1876
|
| 62 |
Ryser H J, Shen W C, Merk F B. Membrane transport of macromolecules: New carrier functions of proteins and poly(amino acids). Life Sciences, 1978, 22(13–15): 1253–1260
|
| 63 |
Pardridge W M, Buciak J L, Kang Y S, Boado R J. Protamine-mediated transport of albumin into brain and other organs of the rat. Binding and endocytosis of protamine-albumin complex by microvascular endothelium. Journal of Clinical Investigation, 1993, 92(5): 2224–2229
|
| 64 |
Wu G Y, Wu C H. Evidence for targeted gene delivery to Hep G2 hepatoma cells in vitro. Biochemistry, 1988, 27(3): 887–892
|
| 65 |
Cotten M, Langle-Rouault F, Kirlappos H, Wagner E, Mechtler K, Zenke M, Beug H, Birnstiel M L. Transferrin-polycation-mediated introduction of DNA into human leukemic cells: Stimulation by agents that affect the survival of transfected DNA or modulate transferrin receptor levels. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(11): 4033–4037
|
| 66 |
Ryser H J, Shen W C. Conjugation of methotrexate to poly(L-lysine) increases drug transport and overcomes drug resistance in cultured cells. Proceedings of the National Academy of Sciences of the United States of America, 1978, 75(8): 3867–3870
|
| 67 |
Shen W C, Ryser H J. Poly (L-lysine) and poly (D-lysine) conjugates of methotrexate: Different inhibitory effect on drug resistant cells. Molecular Pharmacology, 1979, 16(2): 614–622
|
| 68 |
Ryser H J, Shen W C. Conjugation of methotrexate to poly (L-lysine) as a potential way to overcome drug resistance. Cancer, 1980, 45(5 Suppl): 1207–1211
|
| 69 |
Han K, Jeon M J, Kim S H, Ki D, Bahn J H, Lee K S, Park J, Choi S Y. Efficient intracellular delivery of an exogenous protein GFP with genetically fused basic oligopeptides. Molecules and Cells, 2001, 12(2): 267–271
|
| 70 |
Rothbard J B, Jessop T C, Lewis R S, Murray B A, Wender P A. Role of membrane potential and hydrogen bonding in the mechanism of translocation of guanidinium-rich peptides into cells. Journal of the American Chemical Society, 2004, 126(31): 9506–9507
|
| 71 |
Goncalves E, Kitas E, Seelig J. Binding of oligoarginine to membrane lipids and heparan sulfate: Structural and thermodynamic characterization of a cell-penetrating peptide. Biochemistry, 2005, 44(7): 2692–2702
|
| 72 |
Gelman R A, Glaser D N, Blackwell J. Interaction between chondroitin-6-sulfate and poly-L-arginine in aqueous solution. Biopolymers, 1973, 12(6): 1223–1232
|
| 73 |
Richard J P, Melikov K, Brooks H, Prevot P, Lebleu B, Chernomordik L V. Cellular uptake of unconjugated TAT peptide involves clathrin-dependent endocytosis and heparan sulfate receptors. Journal of Biological Chemistry, 2005, 280(15): 15300–15306
|
| 74 |
Jiao C Y, Delaroche D, Burlina F, Alves I D, Chassaing G, Sagan S. Translocation and endocytosis for cell-penetrating peptide internalization. Journal of Biological Chemistry, 2009, 284(49): 33957–33965
|
| 75 |
Zaro J L, Shen W C. Cytosolic delivery of a p16-peptide oligoarginine conjugate for inhibiting proliferation of MCF7 cells. Journal of Controlled Release, 2005, 108(2–3): 409–417
|
| 76 |
Fei L, Ren L, Zaro J L, Shen W C. The influence of net charge and charge distribution on cellular uptake and cytosolic localization of arginine-rich peptides. Journal of Drug Targeting, 2011, 19(8): 675–680
|
| 77 |
Law M, Jafari M, Chen P. Physicochemical characterization of siRNA-peptide complexes. Biotechnology Progress, 2008, 24(4): 957–963
|
| 78 |
Pace C N, Scholtz J M. A helix propensity scale based on experimental studies of peptides and proteins. Biophysical Journal, 1998, 75(1): 422–442, 7
|
| 79 |
Hong M, Su Y. Structure and dynamics of cationic membrane peptides and proteins: Insights from solid-state NMR. Protein Science, 2011, 20(4): 641–655
|
| 80 |
Di Pisa M, Chassaing G, Swiecicki J M. Translocation mechanism(s) of cell-penetrating peptides: Biophysical studies using artificial membrane bilayers. Biochemistry, 2015, 54(2): 194–207
|
| 81 |
Gelman R A, Blackwell J. Heparin-polypeptide interactions in aqueous solution. Archives of Biochemistry and Biophysics, 1973, 159(1): 427–433
|
| 82 |
Shen W C, Ryser H J. Poly(L-lysine) has different membrane transport and drug-carrier properties when complexed with heparin. Proceedings of the National Academy of Sciences of the United States of America, 1981, 78(12): 7589–7593
|
| 83 |
Su Y, Doherty T, Waring A J, Ruchala P, Hong M. Roles of arginine and lysine residues in the translocation of a cell-penetrating peptide from (13)C, (31)P, and (19)F solid-state NMR. Biochemistry, 2009, 48(21): 4587–4595
|
| 84 |
Clark K S, Svetlovics J, McKeown A N, Huskins L, Almeida P F. What determines the activity of antimicrobial and cytolytic peptides in model membranes. Biochemistry, 2011, 50(37): 7919–7932
|
| 85 |
Alves I D, Goasdoue N, Correia I, Aubry S, Galanth C, Sagan S, Lavielle S, Chassaing G. Membrane interaction and perturbation mechanisms induced by two cationic cell penetrating peptides with distinct charge distribution. Biochimica et Biophysica Acta, 2008, 1780(7–8): 948–959
|
| 86 |
Derossi D, Joliot A H, Chassaing G, Prochiantz A. The third helix of the Antennapedia homeodomain translocates through biological membranes. Journal of Biological Chemistry, 1994, 269(14): 10444–10450
|
| 87 |
Kaplan I M, Wadia J S, Dowdy S F. Cationic TAT peptide transduction domain enters cells by macropinocytosis. Journal of Controlled Release, 2005, 102(1): 247–253
|
| 88 |
Wadia J S, Stan R V, Dowdy S F. Transducible TAT-HA fusogenic peptide enhances escape of TAT-fusion proteins after lipid raft macropinocytosis. Nature Medicine, 2004, 10(3): 310–315
|
| 89 |
Yesylevskyy S, Marrink S J, Mark A E. Alternative mechanisms for the interaction of the cell-penetrating peptides penetratin and the TAT peptide with lipid bilayers. Biophysical Journal, 2009, 97(1): 40–49
|
| 90 |
Fittipaldi A, Ferrari A, Zoppe M, Arcangeli C, Pellegrini V, Beltram F, Giacca M. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. Journal of Biological Chemistry, 2003, 278(36): 34141–34149
|
| 91 |
Ferrari M E, Nguyen C M, Zelphati O, Tsai Y, Felgner P L. Analytical methods for the characterization of cationic lipid-nucleic acid complexes. Human Gene Therapy, 1998, 9(3): 341–351
|
| 92 |
Qian Z, LaRochelle J R, Jiang B, Lian W, Hard R L, Selner N G, Luechapanichkul R, Barrios A M, Pei D. Early endosomal escape of a cyclic cell-penetrating peptide allows effective cytosolic cargo delivery. Biochemistry, 2014, 53(24): 4034–4046
|
| 93 |
Lundberg P, El-Andaloussi S, Sutlu T, Johansson H, Langel U. Delivery of short interfering RNA using endosomolytic cell-penetrating peptides. FASEB Journal, 2007, 21(11): 2664–2671
|
| 94 |
Yang S T, Zaitseva E, Chernomordik L V, Melikov K. Cell-penetrating peptide induces leaky fusion of liposomes containing late endosome-specific anionic lipid. Biophysical Journal, 2010, 99(8): 2525–2533
|
| 95 |
Deshayes S, Plenat T, Charnet P, Divita G, Molle G, Heitz F. Formation of transmembrane ionic channels of primary amphipathic cell-penetrating peptides. Consequences on the mechanism of cell penetration. Biochimica et Biophysica Acta, 2006, 1758(11): 1846–1851
|
| 96 |
Kenien R, Shen W C, Zaro J L. Vesicle-to-cytosol transport of disulfide-linked cargo mediated by an amphipathic cell-penetrating peptide. Journal of Drug Targeting, 2012, 20(9): 793–800
|
| 97 |
Kenien R, Zaro J L, Shen W C. MAP-mediated nuclear delivery of a cargo protein. Journal of Drug Targeting, 2012, 20(4): 329–337
|
| 98 |
Shai Y. Mechanism of the binding, insertion and destabilization of phospholipid bilayer membranes by α-helical antimicrobial and cell non-selective membrane-lytic peptides. Biochimica et Biophysica Acta, 1999, 1462(1–2): 55–70
|
| 99 |
Matsuzaki K, Sugishita K, Miyajima K. Interactions of an antimicrobial peptide, magainin 2, with lipopolysaccharide-containing liposomes as a model for outer membranes of gram-negative bacteria. FEBS Letters, 1999, 449(2–3): 221–224
|
| 100 |
Yang L, Harroun T A, Weiss T M, Ding L, Huang H W. Barrel-stave model or toroidal model? A case study on melittin pores. Biophysical Journal, 2001, 81(3): 1475–1485
|
| 101 |
Berlose J P, Convert O, Derossi D, Brunissen A, Chassaing G. Conformational and associative behaviours of the third helix of antennapedia homeodomain in membrane-mimetic environments. European Journal of Biochemistry, 1996, 242(2): 372–386
|
| 102 |
Mor A, Nguyen V H, Delfour A, Migliore-Samour D, Nicolas P. Isolation, amino acid sequence, and synthesis of dermaseptin, a novel antimicrobial peptide of amphibian skin. Biochemistry, 1991, 30(36): 8824–8830
|
| 103 |
Matsuzaki K, Murase O, Fujii N, Miyajima K. An antimicrobial peptide, magainin 2, induced rapid flip-flop of phospholipids coupled with pore formation and peptide translocation. Biochemistry, 1996, 35(35): 11361–11368
|
| 104 |
Matsuzaki K, Murase O, Fujii N, Miyajima K. Translocation of a channel-forming antimicrobial peptide, magainin 2, across lipid bilayers by forming a pore. Biochemistry, 1995, 34(19): 6521–6526
|
| 105 |
Ludtke S J, He K, Heller W T, Harroun T A, Yang L, Huang H W. Membrane pores induced by magainin. Biochemistry, 1996, 35(43): 13723–13728
|
| 106 |
Brauner J W, Mendelsohn R, Prendergast F G. Attenuated total reflectance Fourier transform infrared studies of the interaction of melittin, two fragments of melittin, and δ-hemolysin with phosphatidylcholines. Biochemistry, 1987, 26(25): 8151–8158
|
| 107 |
Frey S, Tamm L K. Orientation of melittin in phospholipid bilayers. A polarized attenuated total reflection infrared study. Biophysical Journal, 1991, 60(4): 922–930
|
| 108 |
Mueller J, Kretzschmar I, Volkmer R, Boisguerin P. Comparison of cellular uptake using 22 CPPs in 4 different cell lines. Bioconjugate Chemistry, 2008, 19(12): 2363–2374
|
| 109 |
Saar K, Lindgren M, Hansen M, Eiriksdottir E, Jiang Y, Rosenthal-Aizman K, Sassian M, Langel U. Cell-penetrating peptides: A comparative membrane toxicity study. Analytical Biochemistry, 2005, 345(1): 55–65
|
| 110 |
El-Andaloussi S, Jarver P, Johansson H J, Langel U. Cargo-dependent cytotoxicity and delivery efficacy of cell-penetrating peptides: A comparative study. Biochemical Journal, 2007, 407(2): 285–292
|
| 111 |
Rothbard J B, Jessop T C, Lewis R S, Murray B A, Wender P A. Role of membrane potential and hydrogen bonding in the mechanism of translocation of guanidinium-rich peptides into cells. Journal of the American Chemical Society, 2004, 126(31): 9506–9507
|
| 112 |
Zaro J L, Shen W C. Quantitative comparison of membrane transduction and endocytosis of oligopeptides. Biochemical and Biophysical Research Communications, 2003, 307(2): 241–247
|
| 113 |
Zaro J L, Shen W C. Evidence that membrane transduction of oligoarginine does not require vesicle formation. Experimental Cell Research, 2005, 307(1): 164–173
|
| 114 |
Patel L N, Zaro J L, Shen W C. Cell penetrating peptides: Intracellular pathways and pharmaceutical perspectives. Pharmaceutical Research, 2007, 24(11): 1977–1992
|
| 115 |
Sawant R, Torchilin V. Intracellular transduction using cell-penetrating peptides. Molecular BioSystems, 2010, 6(4): 628–640
|
| 116 |
Schmidt N, Mishra A, Lai G H, Wong G C L. Arginine-rich cell-penetrating peptides. FEBS Letters, 2010, 584(9): 1806–1813
|
| 117 |
Wender P A, Galliher W C, Goun E A, Jones L R, Pillow T H. The design of guanidinium-rich transporters and their internalization mechanisms. Advanced Drug Delivery Reviews, 2008, 60(4–5): 452–472
|
| 118 |
Ziegler A. Thermodynamic studies and binding mechanisms of cell-penetrating peptides with lipids and glycosaminoglycans. Advanced Drug Delivery Reviews, 2008, 60(4–5): 580–597
|
| 119 |
Jiao C Y, Delaroche D, Burlina F, Alves I D, Chassaing G, Sagan S. Translocation and endocytosis for cell-penetrating peptideinternalization. Journal of Biological Chemistry, 2009, 284(49): 33957–33965
|
| 120 |
Herbig M E, Weller K M, Merkle H P. Reviewing biophysical and cell biological methodologies in cell-penetrating peptide (CPP) research. Critical Reviews in Therapeutic Drug Carrier Systems, 2007, 24(3): 203–255
|
| 121 |
Shen W C. Acid-sensitive dissociation between poly(lysine) and histamine-modified poly(glutamate) as a model for drug-releasing from carriers in endosomes. Biochimica et Biophysica Acta, 1990, 1034(1): 122–124
|
| 122 |
Fei L, Yap L P, Conti P S, Shen W C, Zaro J L. Tumor targeting of a cell penetrating peptide by fusing with a pH-sensitive histidine-glutamate co-oligopeptide. Biomaterials, 2014, 35(13): 4082–4087
|
| 123 |
Sun C, Shen W C, Tu J, Zaro J L. Interaction between cell-penetrating peptides and acid-sensitive anionic oligopeptides as a model for the design of targeted drug carriers. Molecular Pharmaceutics, 2014, 11(5): 1583–1590
|
| 124 |
Olson E S, Aguilera T A, Jiang T, Ellies L G, Nguyen Q T, Wong E H, Gross L A, Tsien R Y. In vivo characterization of activatable cell penetrating peptides for targeting protease activity in cancer. Integrative Biology: Quantitative Biosciences from Nano to Macro, 2009, 1(5–6): 382–393
|
| 125 |
Savariar E N, Felsen C N, Nashi N, Jiang T, Ellies L G, Steinbach P, Tsien R Y, Nguyen Q T. Real-time in vivo molecular detection of primary tumors and metastases with ratiometric activatable cell-penetrating peptides. Cancer Research, 2013, 73(2): 855–864
|
| 126 |
Weinstain R, Savariar E N, Felsen C N, Tsien R Y. In vivo targeting of hydrogen peroxide by activatable cell-penetrating peptides. Journal of the American Chemical Society, 2014, 136(3): 874–877
|
| 127 |
Lee S H, Castagner B, Leroux J C. Is there a future for cell-penetrating peptides in oligonucleotide delivery? European Journal of Pharmaceutics and Biopharmaceutics, 2013, 85(1): 5–11
|
| 128 |
Crombez L, Aldrian-Herrada G, Konate K, Nguyen Q N, McMaster G K, Brasseur R, Heitz F, Divita G. A new potent secondary amphipathic cell-penetrating peptide for siRNA delivery into mammalian cells. Molecular Therapy, 2009, 17(1): 95–103
|
| 129 |
Dubikovskaya E A, Thorne S H, Pillow T H, Contag C H, Wender P A. Overcoming multidrug resistance of small-molecule therapeutics through conjugation with releasable octaarginine transporters. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(34): 12128–12133
|
| 130 |
Liu H, Zhang W, Ma L, Fan L, Gao F, Ni J, Wang R. The improved blood-brain barrier permeability of endomorphin-1 using the cell-penetrating peptide synB3 with three different linkages. International Journal of Pharmaceutics, 2014, 476(1–2): 1–8
|
| 131 |
Hauff S J, Raju S C, Orosco R K, Gross A M, Diaz-Perez J A, Savariar E, Nashi N, Hasselman J, Whitney M, Myers J N, Lippman S M, Tsien R Y, Ideker T, Nguyen Q T. Matrix-metalloproteinases in head and neck carcinoma-cancer genome atlas analysis and fluorescence imaging in mice. Otolaryngology- Head and Neck Surgery, 2014, 151(4): 612–618
|
| 132 |
Gotanda Y, Wei F Y, Harada H, Ohta K, Nakamura K, Tomizawa K, Ushijima K. Efficient transduction of 11 poly-arginine peptide in an ischemic lesion of mouse brain. Journal of Stroke and Cerebrovascular Diseases, 2014, 23(8): 2023–2030
|
| 133 |
van Duijnhoven S M, Robillard M S, Hermann S, Kuhlmann M T, Schafers M, Nicolay K, Grull H. Imaging of MMP activity in postischemic cardiac remodeling using radiolabeled MMP-2/9 activatable peptide probes. Molecular Pharmaceutics, 2014, 11(5): 1415–1423
|
| 134 |
Neundorf I, Rennert R, Franke J, Kozle I, Bergmann R. Detailed analysis concerning the biodistribution and metabolism of human calcitonin-derived cell-penetrating peptides. Bioconjugate Chemistry, 2008, 19(8): 1596–1603
|
| 135 |
Weiss H M, Wirz B, Schweitzer A, Amstutz R, Rodriguez Perez M I, Andres H, Metz Y, Gardiner J, Seebach D. ADME investigations of unnatural peptides: Distribution of a 14C-labeled β 3-octaarginine in rats. Chemistry & Biodiversity, 2007, 4(7): 1413–1437
|
| 136 |
Sehgal I, Sibrian-Vazquez M, Vicente M G. Photoinduced cytotoxicity and biodistribution of prostate cancer cell-targeted porphyrins. Journal of Medicinal Chemistry, 2008, 51(19): 6014–6020
|
| 137 |
Felsen C N, Savariar E N, Whitney M, Tsien R Y. Detection and monitoring of localized matrix metalloproteinase upregulation in a murine model of asthma. American Journal of Physiology. Lung Cellular and Molecular Physiology, 2014, 306(8): L764–L774
|
| 138 |
Michiue H, Sakurai Y, Kondo N, Kitamatsu M, Bin F, Nakajima K, Hirota Y, Kawabata S, Nishiki T, Ohmori I, Tomizawa K, Miyatake S, Ono K, Matsui H. The acceleration of boron neutron capture therapy using multi-linked mercaptoundecahydrododecaborate (BSH) fused cell-penetrating peptide. Biomaterials, 2014, 35(10): 3396–3405
|
| 139 |
Temming R P, Eggermont L, van Eldijk M B, van Hest J C, van Delft F L. N-Terminal dual protein functionalization by strain-promoted alkyne-nitrone cycloaddition. Organic & Biomolecular Chemistry, 2013, 11(17): 2772–2779
|
| 140 |
Shen W C, Ryser H J. Cis-Aconityl spacer between daunomycin and macromolecular carriers: A model of pH-sensitive linkage releasing drug from a lysosomotropic conjugate. Biochemical and Biophysical Research Communications, 1981, 102(3): 1048–1054
|
| 141 |
Walker L, Perkins E, Kratz F, Raucher D. Cell penetrating peptides fused to a thermally targeted biopolymer drug carrier improve the delivery and antitumor efficacy of an acid-sensitive doxorubicin derivative. International Journal of Pharmaceutics, 2012, 436(1–2): 825–832
|
| 142 |
Nakase I, Konishi Y, Ueda M, Saji H, Futaki S. Accumulation of arginine-rich cell-penetrating peptides in tumors and the potential for anticancer drug delivery in vivo. Journal of Controlled Release, 2012, 159(2): 181–188
|
| 143 |
Vives E. Present and future of cell-penetrating peptide mediated delivery systems: Is the Trojan horse too wild to go only to Troy? Journal of Controlled Release, 2005, 109(1–3): 77–85
|
| 144 |
Vives E, Schmidt J, Pelegrin A. Cell-penetrating and cell-targeting peptides in drug delivery. Biochimica et Biophysica Acta, 2008, 1786(2): 126–138
|
| 145 |
Heitz F, Morris M C, Divita G. Twenty years of cell-penetrating peptides: from molecular mechanisms to therapeutics. British Journal of Pharmacology, 2009, 157(2): 195–206
|
| 146 |
Sarko D, Beijer B, Garcia B R, Nothelfer E M, Leotta K, Eisenhut M, Altmann A, Haberkorn U, Mier W. The pharmacokinetics of cell-penetrating peptides. Molecular Pharmaceutics, 2010, 7(6): 2224–2231
|
| 147 |
Hamann P R, Hinman L M, Beyer C F, Lindh D, Upeslacis J, Flowers D A, Bernstein I. An anti-CD33 antibody-calicheamicin conjugate for treatment of acute myeloid leukemia. Choice of linker. Bioconjugate Chemistry, 2002, 13(1): 40–46
|
| 148 |
Anderson D C, Nichols E, Manger R, Woodle D, Barry M, Fritzberg A R. Tumor cell retention of antibody Fab fragments is enhanced by an attached HIV TAT protein-derived peptide. Biochemical and Biophysical Research Communications, 1993, 194(2): 876–884
|
| 149 |
Trudel D, Fradet Y, Meyer F, Harel F, Tetu B. Significance of MMP-2 expression in prostate cancer: An immunohistochemical study. Cancer Research, 2003, 63(23): 8511–8515
|
| 150 |
Turpeenniemi-Hujanen T. Gelatinases (MMP-2 and-9) and their natural inhibitors as prognostic indicators in solid cancers. Biochimie, 2005, 87(3–4): 287–297
|
| 151 |
Gerweck L E, Seetharaman K. Cellular pH gradient in tumor versus normal tissue: Potential exploitation for the treatment of cancer. Cancer Research, 1996, 56(6): 1194–1198
|
| 152 |
Getzenberg R H, Coffey D S, DeWeese T L. Hyperthermic biology and cancer therapies a hypothesis for the “Lance Armstrong effect”. Journal of the American Medical Association, 2006, 296(4): 445–448
|
| 153 |
Denko N, Cairns R, Papandreou I. Overcoming physiologic barriers to cancer treatment by molecularly targeting the tumor microenvironment. Molecular Cancer Research, 2006, 4(2): 61–70
|
| 154 |
Crisp J L, Savariar E N, Glasgow H L, Ellies L G, Whitney M A, Tsien R Y. Dual targeting of integrin αvβ3 and matrix metalloproteinase-2 for optical imaging of tumors and chemotherapeutic delivery. Molecular Cancer Therapeutics, 2014, 13(6): 1514–1525
|
| 155 |
Nguyen Q T, Olson E S, Aguilera T A, Jiang T, Scadeng M, Ellies L G, Tsien R Y. Surgery with molecular fluorescence imaging using activatable cell-penetrating peptides decreases residual cancer and improves survival. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(9): 4317–4322
|
| 156 |
van Duijnhoven S M, Robillard M S, Nicolay K, Grull H. Tumor targeting of MMP-2/9 activatable cell-penetrating imaging probes is caused by tumor-independent activation. Journal of Nuclear Medicine, 2011, 52(2): 279–286
|
| 157 |
Zaro J L, Fei L, Shen W C. Recombinant peptide constructs for targeted cell penetrating peptide-mediated delivery. Journal of Controlled Release, 2012, 158(3): 357–361
|
| 158 |
Zhu L, Kate P, Torchilin V P. Matrix metalloprotease 2-responsive multifunctional liposomal nanocarrier for enhanced tumor targeting. ACS Nano, 2012, 6(4): 3491–3498
|
| 159 |
Apte A, Koren E, Koshkaryev A, Torchilin V P. Doxorubicin in TAT peptide-modified multifunctional immunoliposomes demonstrates increased activity against both drug-sensitive and drug-resistant ovarian cancer models. Cancer Biology & Therapy, 2014, 15(1): 69–80
|
| 160 |
Leader B, Baca Q J, Golan D E. Protein therapeutics: A summary and pharmacological classification. Nature Reviews. Drug Discovery, 2008, 7(1): 21–39
|
| 161 |
He H, Sheng J, David A E, Kwon Y M, Zhang J, Huang Y, Wang J, Yang V C. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials, 2013, 34(31): 7733–7743
|
| 162 |
Liang J F, Yang V C. Insulin-cell penetrating peptide hybrids with improved intestinal absorption efficiency. Biochemical and Biophysical Research Communications, 2005, 335(3): 734–738
|
| 163 |
Liu E, Sheng J, Ye J, Wang Y, Gong J, Yang V C, Wang J, He H. CPP mediated insulin delivery: Current status and promising future. Current Pharmaceutical Biotechnology, 2014, 15(3): 240–255
|
| 164 |
Fei L. Cell Penetrating Peptide-Based Drug Delivery System for Targeting Mildly Acidic pH. Dissertation for the Doctoral Degree. California: University of Southern California, 2014
|
| 165 |
Chen X, Zaro J L, Shen W C. Fusion protein linkers: Property, design and functionality. Advanced Drug Delivery Reviews, 2013, 65(10): 1357–1369
|
| 166 |
Almeida P F. Membrane-active peptides: Binding, translocation, and flux in lipid vesicles. Biochimica et Biophysica Acta, 2014, 1838(9): 2216–2227
|
| 167 |
Shin M C, Zhang J, Min K A, Lee K, Moon C, Balthasar J P, Yang V C. Combination of antibody targeting and PTD-mediated intracellular toxin delivery for colorectal cancer therapy. Journal of Controlled Release, 2014, 194: 197–210
|
| 168 |
Xu J, Xiang Q, Su J, Yang P, Zhang Q, Su Z, Xiao F, Huang Y. Evaluation of the safety and brain-related tissues distribution characteristics of TAT-HaFGF via intranasal administration. Biological & Pharmaceutical Bulletin, 2014, 37(7): 1149–1157
|
| 169 |
Cai S R, Xu G, Becker-Hapak M, Ma M, Dowdy S F, McLeod H L. The kinetics and tissue distribution of protein transduction in mice. European Journal of Pharmaceutical Sciences, 2006, 27(4): 311–319
|
| 170 |
Cerchietti L C, Yang S N, Shaknovich R, Hatzi K, Polo J M, Chadburn A, Dowdy S F, Melnick A. A peptomimetic inhibitor of BCL6 with potent antilymphoma effects in vitro and in vivo. Blood, 2009, 113(15): 3397–3405
|
| 171 |
Bowne W B, Michl J, Bluth M H, Zenilman M E, Pincus M R. Novel peptides from the RAS-p21 and p53 proteins for the treatment of cancer. Cancer Therapy, 2007, 5B: 331–344
|
| 172 |
Kwon M K, Nam J O, Park R W, Lee B H, Park J Y, Byun Y R, Kim S Y, Kwon I C, Kim I S. Antitumor effect of a transducible fusogenic peptide releasing multiple proapoptotic peptides by caspase-3. Molecular Cancer Therapeutics, 2008, 7(6): 1514–1522
|
| 173 |
Tan M, Lan K H, Yao J, Lu C H, Sun M, Neal C L, Lu J, Yu D. Selective inhibition of ErbB2-overexpressing breast cancer in vivo by a novel TAT-based ErbB2-targeting signal transducers and activators of transcription 3-blocking peptide. Cancer Research, 2006, 66(7): 3764–3772
|
| 174 |
Shibata W, Maeda S, Hikiba Y, Yanai A, Ohmae T, Sakamoto K, Nakagawa H, Ogura K, Omata M. Cutting edge: The IkappaB kinase (IKK) inhibitor, NEMO-binding domain peptide, blocks inflammatory injury in murine colitis. Journal of Immunology, 2007, 179(5): 2681–2685
|
| 175 |
Ghosh A, Roy A, Liu X, Kordower J H, Mufson E J, Hartley D M, Ghosh S, Mosley R L, Gendelman H E, Pahan K. Selective inhibition of NF-kappaB activation prevents dopaminergic neuronal loss in a mouse model of Parkinson’s disease. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(47): 18754–18759
|
| 176 |
Hotchkiss R S, McConnell K W, Bullok K, Davis C G, Chang K C, Schwulst S J, Dunne J C, Dietz G P, Bahr M, McDunn J E, Karl I E, Wagner T H, Cobb J P, Coopersmith C M, Piwnica-Worms D. TAT-BH4 and TAT-Bcl-xL peptides protect against sepsis-induced lymphocyte apoptosis in vivo. Journal of Immunology (Baltimore, MD.: 1950), 2006, 176(9): 5471–5477
|
| 177 |
McCusker C T, Wang Y, Shan J, Kinyanjui M W, Villeneuve A, Michael H, Fixman E D. Inhibition of experimental allergic airways disease by local application of a cell-penetrating dominant-negative STAT-6 peptide. Journal of Immunology, 2007, 179(4): 2556–2564
|
| 178 |
Walker L R, Ryu J S, Perkins E, McNally L R, Raucher D. Fusion of cell-penetrating peptides to thermally responsive biopolymer improves tumor accumulation of p21 peptide in a mouse model of pancreatic cancer. Drug Design, Development and Therapy, 2014, 8: 1649–1658
|
| 179 |
Qiu X, Johnson J R, Wilson B S, Gammon S T, Piwnica-Worms D, Barnett E M. Single-cell resolution imaging of retinal ganglion cell apoptosis in vivo using a cell-penetrating caspase-activatable peptide probe. PLoS One, 2014, 9(2): e88855
|
| 180 |
He X H, Yan X T, Wang Y L, Wang C Y, Zhang Z Z, Zhan J. Transduced PEP-1-heme oxygenase-1 fusion protein protects against intestinal ischemia/reperfusion injury. Journal of Surgical Research, 2014, 187(1): 77–84
|
| 181 |
He X H, Wang Y, Yan X T, Wang Y L, Wang C Y, Zhang Z Z, Li H, Jiang H X. Transduction of PEP-1-heme oxygenase-1 fusion protein reduces myocardial ischemia/reperfusion injury in rats. Journal of Cardiovascular Pharmacology, 2013, 62(5): 436–442
|
| 182 |
McCarthy H O, McCaffrey J, McCrudden C M, Zholobenko A, Ali A A, McBride J W, Massey A S, Pentlavalli S, Chen K H, Cole G, Loughran S P, Dunne N J, Donnelly R F, Kett V L, Robson T. Development and characterization of self-assembling nanoparticles using a bio-inspired amphipathic peptide for gene delivery. Journal of Controlled Release, 2014, 189: 141–149
|
| 183 |
Wang H, Wang H, Liang J, Jiang Y, Guo Q, Peng H, Xu Q, Huang Y. Cell-penetrating apoptotic peptide/p53 DNA nanocomplex as adjuvant therapy for drug-resistant breast cancer. Molecular Pharmaceutics, 2014, 11(10): 3352–3360
|
| 184 |
Hu Y, Xu B, Ji Q, Shou D, Sun X, Xu J, Gao J, Liang W. A mannosylated cell-penetrating peptide-graft-polyethylenimine as a gene delivery vector. Biomaterials, 2014, 35(13): 4236–4246
|
| 185 |
Wang H X, Yang X Z, Sun C Y, Mao C Q, Zhu Y H, Wang J. Matrix metalloproteinase 2-responsive micelle for siRNA delivery. Biomaterials, 2014, 35(26): 7622–7634
|
| 186 |
Nielsen E J, Yoshida S, Kamei N, Iwamae R, Khafagy E S, Olsen J, Rahbek U L, Pedersen B L, Takayama K, Takeda-Morishita M. Khafagy el S, Olsen J, Rahbek U L, Pedersen B L, Takayama K, Takeda-Morishita M. in vivo proof of concept of oral insulin delivery based on a co-administration strategy with the cell-penetrating peptide penetratin. Journal of Controlled Release, 2014, 189: 19–24
|
| 187 |
Manosroi J, Lohcharoenkal W, Gotz F, Werner R G, Manosroi W, Manosroi A. Novel application of polioviral capsid: Development of a potent and prolonged oral calcitonin using polioviral binding ligand and Tat peptide. Drug Development and Industrial Pharmacy, 2014, 40(8): 1092–1100
|
| 188 |
Wiethoff C M, Middaugh C R. Barriers to nonviral gene delivery. Journal of Pharmaceutical Sciences, 2003, 92(2): 203–217
|
| 189 |
Nam H Y, Kim J, Kim S, Yockman J W, Kim S W, Bull D A. Cell penetrating peptide conjugated bioreducible polymer for siRNA delivery. Biomaterials, 2011, 32(22): 5213–5222
|
| 190 |
Mo R H, Zaro J L, Shen W C. Comparison of cationic and amphipathic cell penetrating peptides for siRNA delivery and efficacy. Molecular Pharmaceutics, 2012, 9(2): 299–309
|
| 191 |
Margus H, Padari K, Pooga M. Cell-penetrating peptides as versatile vehicles for oligonucleotide delivery. Molecular Therapy, 2012, 20(3): 525–533
|
| 192 |
Amidon G L, Lee H J. Absorption of peptide and peptidomimetic drugs. Annual Review of Pharmacology and Toxicology, 1994, 34(1): 321–341
|
| 193 |
Farkhani S M, Valizadeh A, Karami H, Mohammadi S, Sohrabi N, Badrzadeh F. Cell penetrating peptides: Efficient vectors for delivery of nanoparticles, nanocarriers, therapeutic and diagnostic molecules. Peptides, 2014, 57: 78–94
|
| 194 |
Cleal K, He L, Watson P D, Jones A T. Endocytosis, intracellular traffic and fate of cell penetrating peptide based conjugates and nanoparticles. Current Pharmaceutical Design, 2013, 19(16): 2878–2894
|
| 195 |
Zhang B, Zhang Y, Liao Z, Jiang T, Zhao J, Tuo Y, She X, Shen S, Chen J, Zhang Q, Jiang X, Hu Y, Pang Z. UPA-sensitive ACPP-conjugated nanoparticles for multi-targeting therapy of brain glioma. Biomaterials, 2015, 36: 98–109
|
| 196 |
Mei L, Zhang Q, Yang Y, He Q, Gao H. Angiopep-2 and activatable cell penetrating peptide dual modified nanoparticles for enhanced tumor targeting and penetrating. International Journal of Pharmaceutics, 2014, 474(1–2): 95–102
|
| 197 |
Fan T, Chen C, Guo H, Xu J, Zhang J, Zhu X, Yang Y, Zhou Z, Li L, Huang Y. Design and evaluation of solid lipid nanoparticles modified with peptide ligand for oral delivery of protein drugs. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 88(2): 518–528
|
| 198 |
Huang A, Su Z, Li S, Sun M, Xiao Y, Ping Q, Deng Y. Oral absorption enhancement of salmon calcitonin by using both N-trimethyl chitosan chloride and oligoarginines-modified liposomes as the carriers. Drug Delivery, 2014, 21(5): 388–396
|
| 199 |
Gao H, Zhang S, Cao S, Yang Z, Pang Z, Jiang X. Angiopep-2 and activatable cell-penetrating peptide dual-functionalized nanoparticles for systemic glioma-targeting delivery. Molecular Pharmaceutics, 2014, 11(8): 2755–2763
|
| 200 |
Yang Y, Yang Y, Xie X, Cai X, Zhang H, Gong W, Wang Z, Mei X. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials, 2014, 35(14): 4368–4381
|
| 201 |
Zong T, Mei L, Gao H, Cai W, Zhu P, Shi K, Chen J, Wang Y, Gao F, He Q. Synergistic dual-ligand doxorubicin liposomes improve targeting and therapeutic efficacy of brain glioma in animals. Molecular Pharmaceutics, 2014, 11(7): 2346–2357
|
| 202 |
Liu Y, Ran R, Chen J, Kuang Q, Tang J, Mei L, Zhang Q, Gao H, Zhang Z, He Q. Paclitaxel loaded liposomes decorated with a multifunctional tandem peptide for glioma targeting. Biomaterials, 2014, 35(17): 4835–4847
|
| 203 |
Tang J, Zhang L, Liu Y, Zhang Q, Qin Y, Yin Y, Yuan W, Yang Y, Xie Y, Zhang Z, He Q. Synergistic targeted delivery of payload into tumor cells by dual-ligand liposomes co-modified with cholesterol anchored transferrin and TAT. International Journal of Pharmaceutics, 2013, 454(1): 31–40
|
| 204 |
Wang J, Yu Y, Yan Z, Hu Z, Li L, Li J, Jiang X, Qian Q. Anticancer activity of oncolytic adenoviruses carrying p53 is augmented by 11R in gallbladder cancer cell lines in vitro and in vivo. Oncology Reports, 2013, 30(2): 833–841
|
| 205 |
Tang J, Fu H, Kuang Q, Zhang L, Zhang Q, Liu Y, Ran R, Gao H, Zhang Z, He Q. Liposomes co-modified with cholesterol anchored cleavable PEG and octaarginines for tumor targeted drug delivery. Journal of Drug Targeting, 2014, 22(4): 313–326
|
| 206 |
Shamay Y, Shpirt L, Ashkenasy G, David A. Complexation of cell-penetrating peptide-polymer conjugates with polyanions controls cells uptake of HPMA copolymers and anti-tumor activity. Pharmaceutical Research, 2014, 31(3): 768–779
|
| 207 |
Wang Y, Dou L, He H, Zhang Y, Shen Q. Multifunctional nanoparticles as nanocarrier for vincristine sulfate delivery to overcome tumor multidrug resistance. Molecular Pharmaceutics, 2014, 11(3): 885–894
|
| 208 |
Nakamura T, Yamazaki D, Yamauchi J, Harashima H. The nanoparticulation by octaarginine-modified liposome improves alpha-galactosylceramide-mediated antitumor therapy via systemic administration. Journal of Controlled Release, 2013, 171(2): 216–224
|
/
| 〈 |
|
〉 |